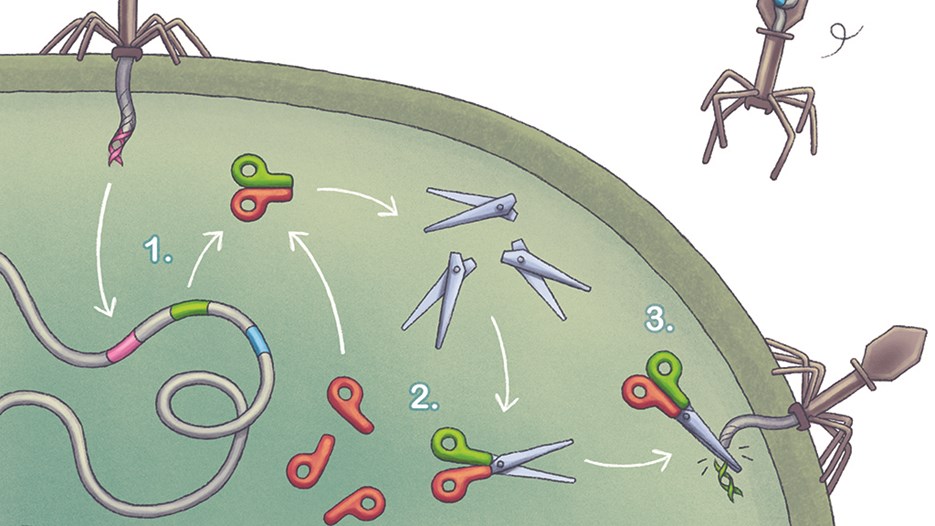
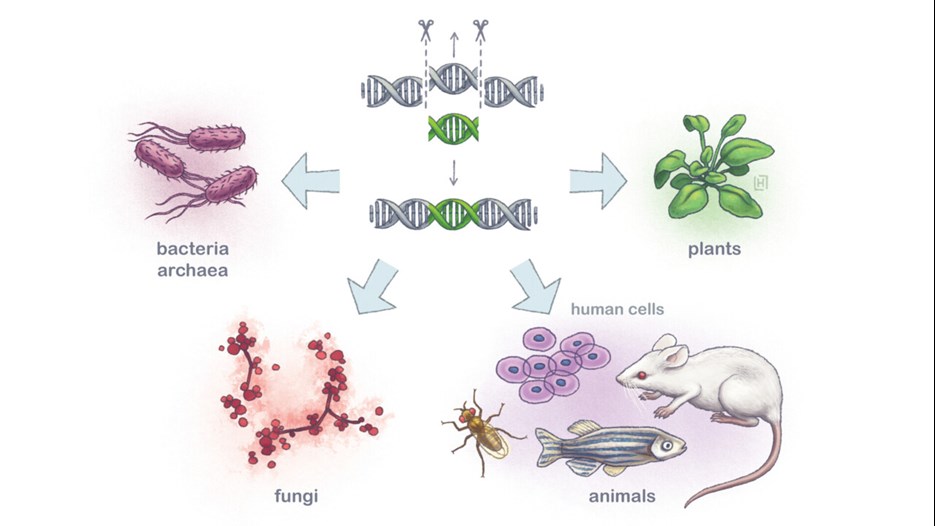
Emmanuelle Charpentier
Född: 1968 i Juvisy-sur-Orge, 20 km sydost om Paris, Frankrike.
Arbetar som: Föreståndare till sin egen institution inom Max-Planck-sällskapet, The Max Planck Unit for the Science of Pathogens, Berlin, Tyskland och Hedersprofessor vid Humboldt-Universität zu Berlin, Tyskland. Hedersdoktor vid Umeå universitet 2017.Tidigare gruppledare vid Helmholtz-Zentrum für Infektionsforschung, Braunschweig och professor vid Medizinische Hochschule Hannover, båda Tyskland, samt gästprofessor och gruppledare vid Umeå universitet.
På fritiden: ”Jag har arbetat väldigt mycket de senaste åren, och ännu mer till följd av all uppmärksamhet kring CRISPR-Cas9, men jag försöker verkligen också hinna med andra intressen, som olika sportaktiviteter. Jag är väldigt intresserad av kultur, konst och design. Jag kan i alla fall ta mig tid att lyssna till musik när jag arbetar, går och tänker. Jag lyssnar gärna på filosofers och sociologers debatter som ifrågasätter vår värld och vårt samhälle. Det är där jag hittar min balans och energi.”
Bästa transportsättet: ”Cykeln! Den använder jag var jag än är – Paris, New York, Wien, Umeå, Braunschweig, och numera dagligen i Berlin.”
Om att flytta till Umeå: ”Det fanns kanske de som undrade hur en fransk citytjej skulle trivas här, men jag fann mig tillrätta väldigt bra. Det är en internationell miljö med forskare och studenter från hela världen, det märks även när du går på stan och i kulturutbudet. Jag blev också tagen av naturen här, och snön och den torra kylan är klart roligare än de regniga vintrarna i Wien.”