Om den vetenskapliga publiceringen
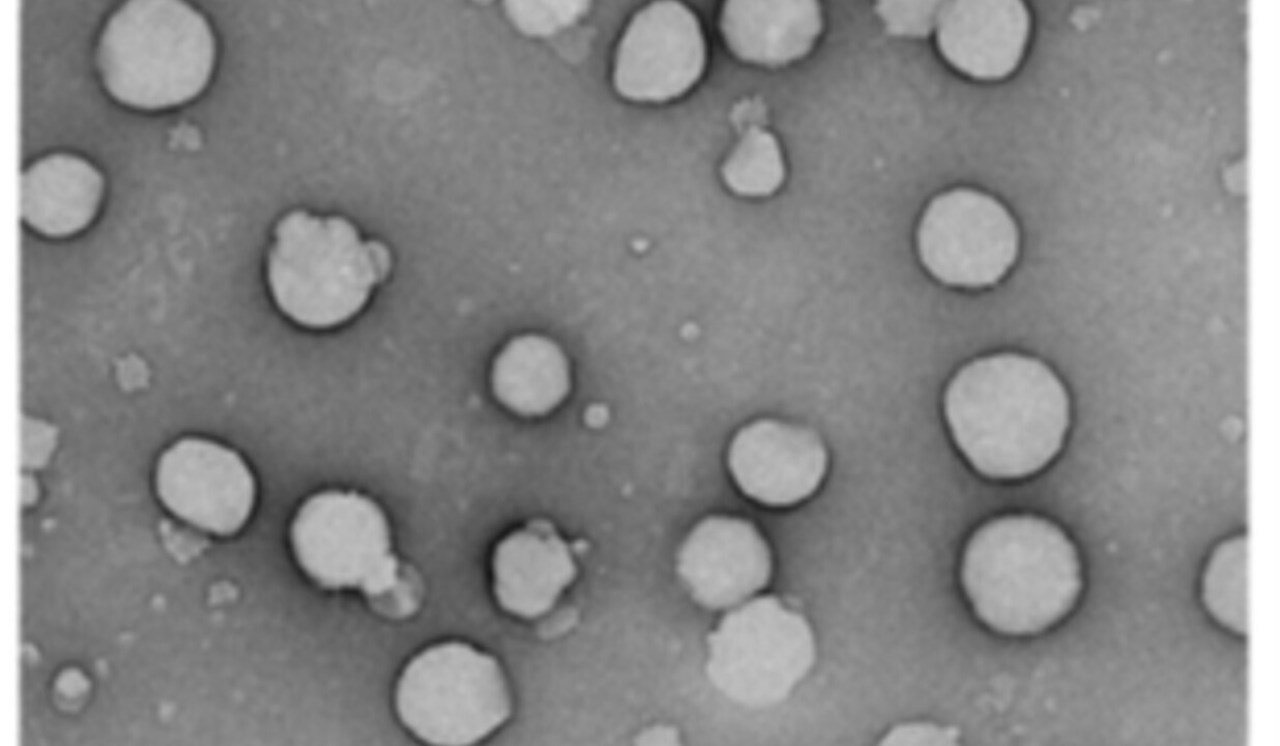
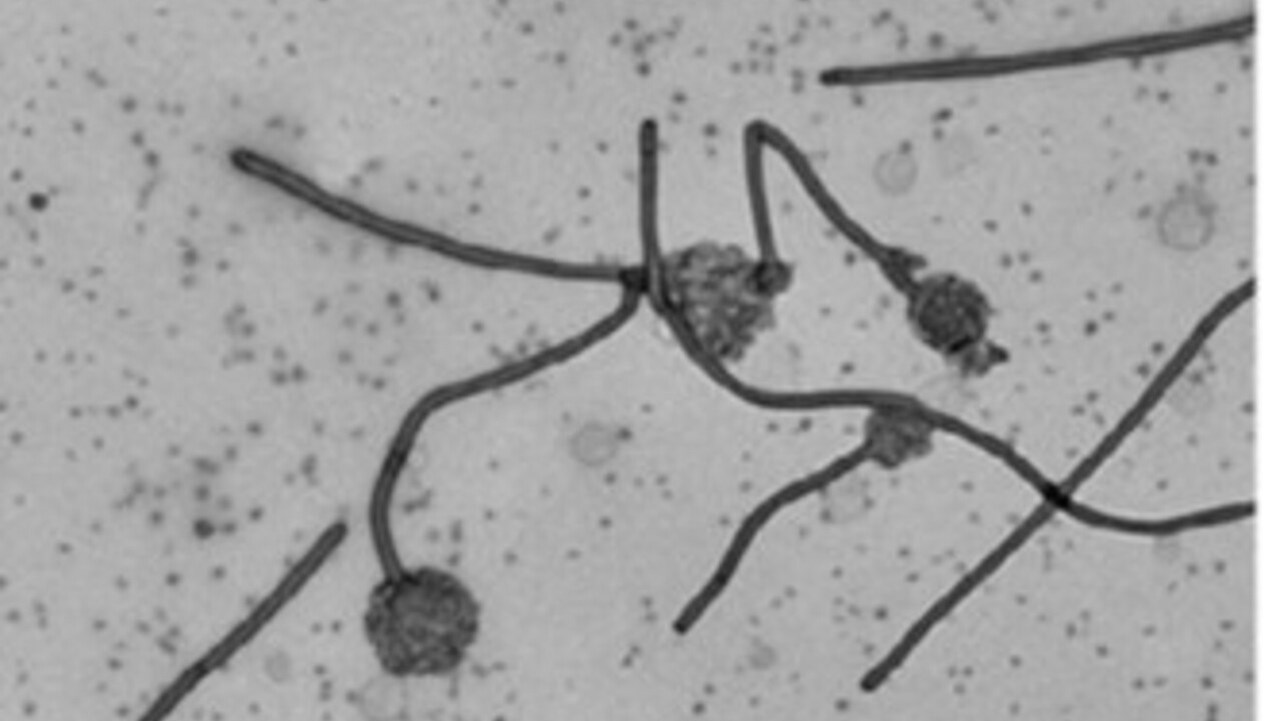
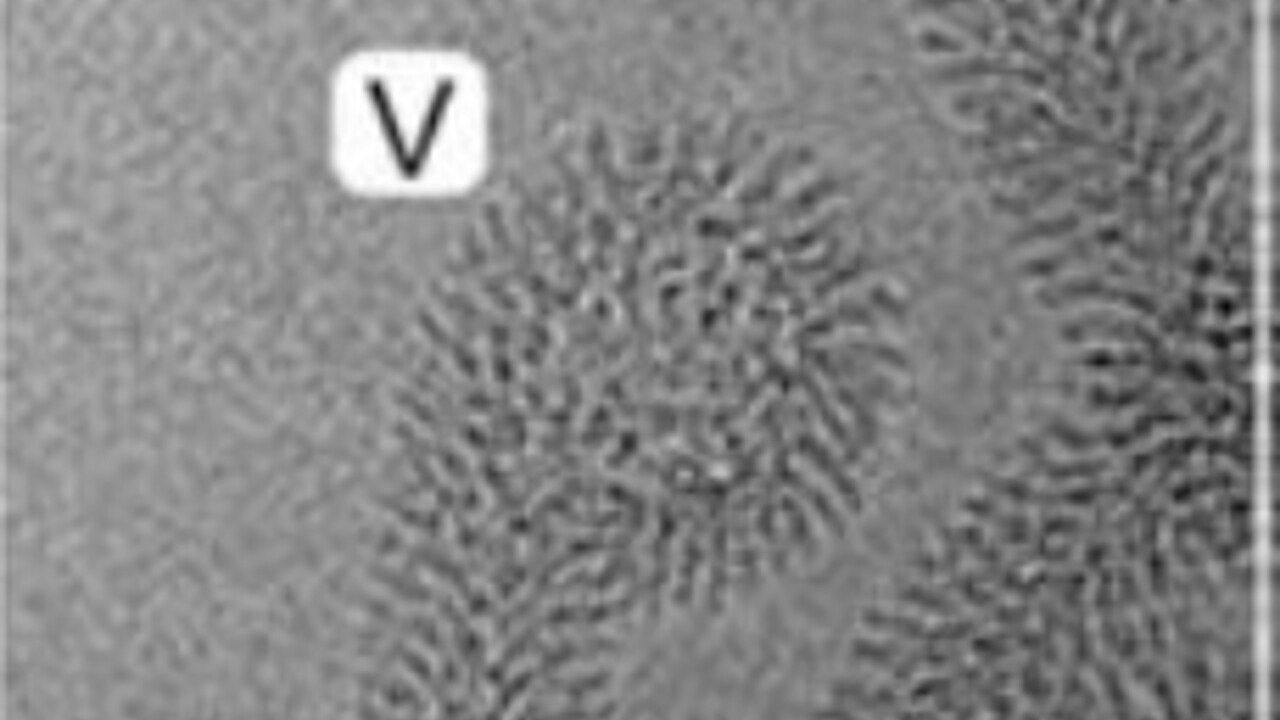
Protein-lipid interaction at low pH induces oligomerisation of the MakA cytotoxin from Vibrio cholerae.
Aftab Nadeem, Alexandra Berg, Hudson Pace, Athar Alam, Eric Toh, Jörgen Ådén, Nikola Zlatkov, Si Lhyam Myint, Karina Persson, Gerhard Gröbner, Anders Sjöstedt, Marta Bally, Jonas Barandun, Bernt Eric Uhlin, Sun Nyunt Wai (2022).
eLife 2022;11:e73439.
DOI: https://doi.org/10.7554/eLife.73439