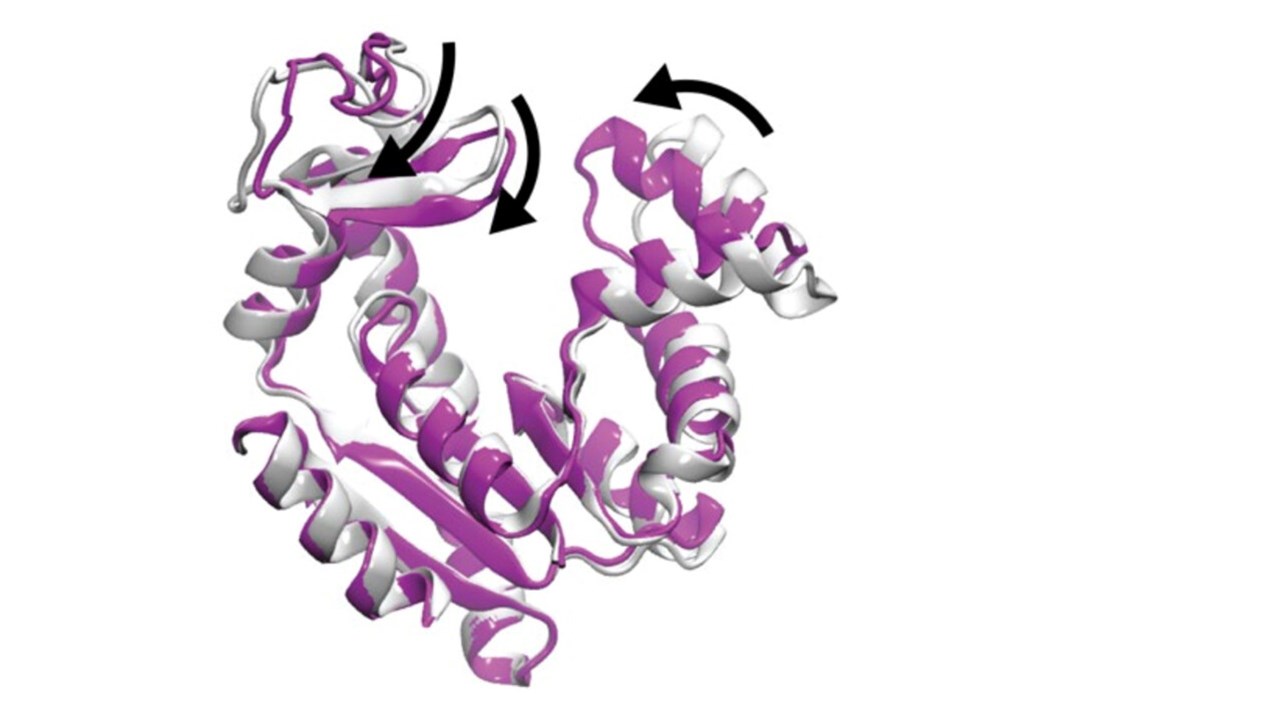
Om den vetenskapliga artikeln:
Orädd, F., Ravishankar, H., Goodman, J., Rogne, P., Backman, L., Duelli, A., Pedersen, M.N., Levantino, M., Wuljj, M., Wolf-Watz, M., Andersson, M.: Tracking the ATP-binding response in adenylate kinase in real time. Science Advances in press.
DOI: 10.1126/sciadv.abi5514