
Bild: Anna Bergonzini

Bild: Anna Bergonzini
Forskargrupp Vi forskar om bakteriella genotoxiners roll vid modulering av homeostas i slemhinnan.
Teresa Frisan Lab har sedan lång tid tillbaka varit intresserad av att förstå effekterna på eukaryota celler och rollen på akuta och kroniska bakterieinfektioner av en relativ ny familj av bakteriella toxiner, definierade som genotoxiner, eftersom de inducerar DNA-skador i värdcellerna.
För närvarande har endast tre bakteriella genotoxiner identifierats: kolibaktin som produceras av Escherichia coli (inklusive kommensala och probiotiska stammar), Klebsiella pneumoniae, Enterobacter aerogenes och Citrobacter koseri; Cytolethaldistending toxin (CDT) familj produceras av flera Gram-negativa patogener. Tyfoidtoxinet som framställs av salmonella enterica serovar Typhi och andra nontyphoidal Salmonella (NTS) serotyper.
Labbets ursprungliga fokus var att förstå verkningssättet för den första upptäckta medlemmen i denna familj: CDT, som fortfarande inte var karakteriserad. Vi har visat att exponering för höga doser av toxin aktiverar den klassiska DNA-skadesvaret (DDR), orkestrerat av DDR-sensorn kinas Ataxia Telengiectasia Muterad (ATM) kinas som leder till aktivering av kontrollpunktsvar som blockerar cellproliferationen och aktiverar DNA-reparationsmekanismer. Om DNA-skadan inte går att reparera genomgår de flesta av de däggdjurscelltyper som testas en begynnande ålderdom, medan T- och B-lymfocyter är mer mottagliga för att dö av apoptos. Omvänt har exponering av för låga doser av toxin visat sig främja klassiska tecken på cancerframkallande processer, såsom cellöverlevnad och förvärv av genomisk instabilitet.
Det finns flera förbryllande frågor som fortfarande måste tas upp inom ramen för detta område, till exempel: varför bakterier har förvärvat dessa ovanliga effektorfunktioner som riktar sig mot däggdjurs-DNA, och som till skillnad från andra väl karakteriserade bakteriella toxiner, inte orsakar en omedelbar celldöd i de flesta värdcellerna, men främjar begynnande ålderdom, kännetecknad av en aktiv sekretorisk fenotyp? Varför intestinala kommensala bakterier och probiotika också producerar dessa effektorfunktioner? Fyller dessa genotoxiner en annorlunda roll när de produceras av patogena bakterier? Kan dessa toxiner utöva cancerframkallande effekter vid kroniska infektioner, och om ja under vilka förhållanden?
För att svara på dessa frågor har vi utvecklat en in vivo-modell för att bedöma rollen för det tyfoidtoxin som produceras av S. Typhi. Vi har valt denna bakterie eftersom det är den enda genotoxinproducerande bakterien som kan orsaka kroniska infektioner och är förknippad med ökad risk för tumörutveckling hos människor. Detta innebär dock en utmaning eftersom S. Typhi är en exklusiv mänsklig patogen. Därför har vi konstruerat flera S.Typhimurium-stammar som antingen uttrycker en funktionell (figur 1) eller icke-funktionell tyfoid toxin och som orsakar en systemisk tyfoid-liknande infektion hos immunkompetenta möss.
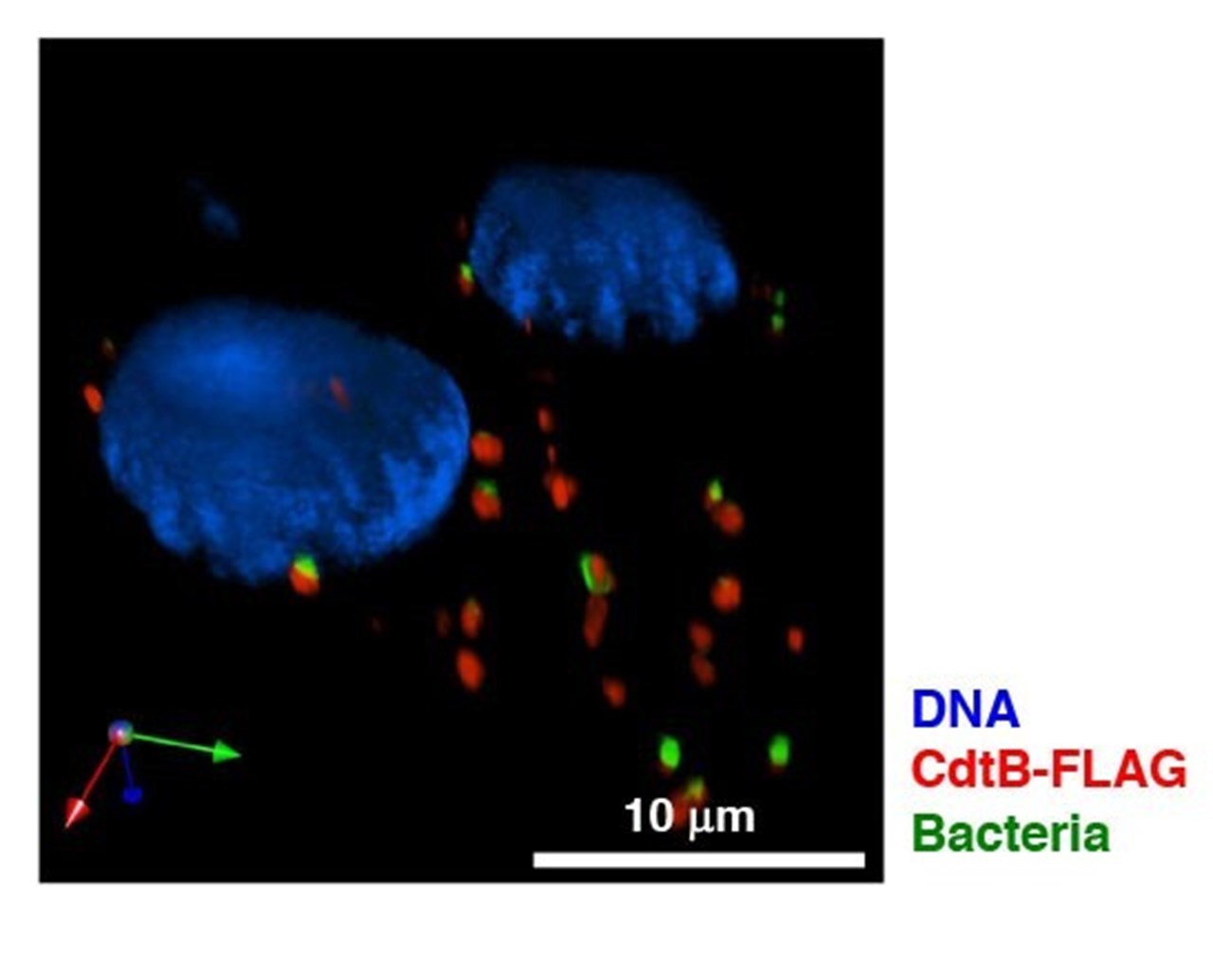
BildTeresa Frisan
Figur 1. Påvisande av DNA-skadliga CdtB-underenheten (röd) av tyfoidtoxinet genom immunofluorescensanalys i humana intestinala epitelial Caco-2 celler infekterade i 24h med en GFP-märkt S. Typhimurium stam MC1-TT (grön). Cellkärnor infärgade med DAPI (blå).
Oväntat orsakar infektion med S. enterica som uttrycker tyfoidtoxinet inte akut celldöd men spelar en nyckelroll i omprogrammering av värdens immunsvar mot en antiinflammatorisk status (figur 2) och gynnar upprättandet av en ihållande infektion. Denna effekt på värdens immunsvar är vävnadsspecifik, eftersom den observeras i tjocktarmen, men inte i lever och mjälte. Resultaten pekar på att denna ovanliga bakteriella effektorn inte är ett klassiskt toxin, men fungerar som immunmodulator, vilket belyser en komplex och vävnadsspecifik överhörning mellan två mycket bevarade stressreaktioner: immunförsvaret och DNA-skadesvaret (DDR).
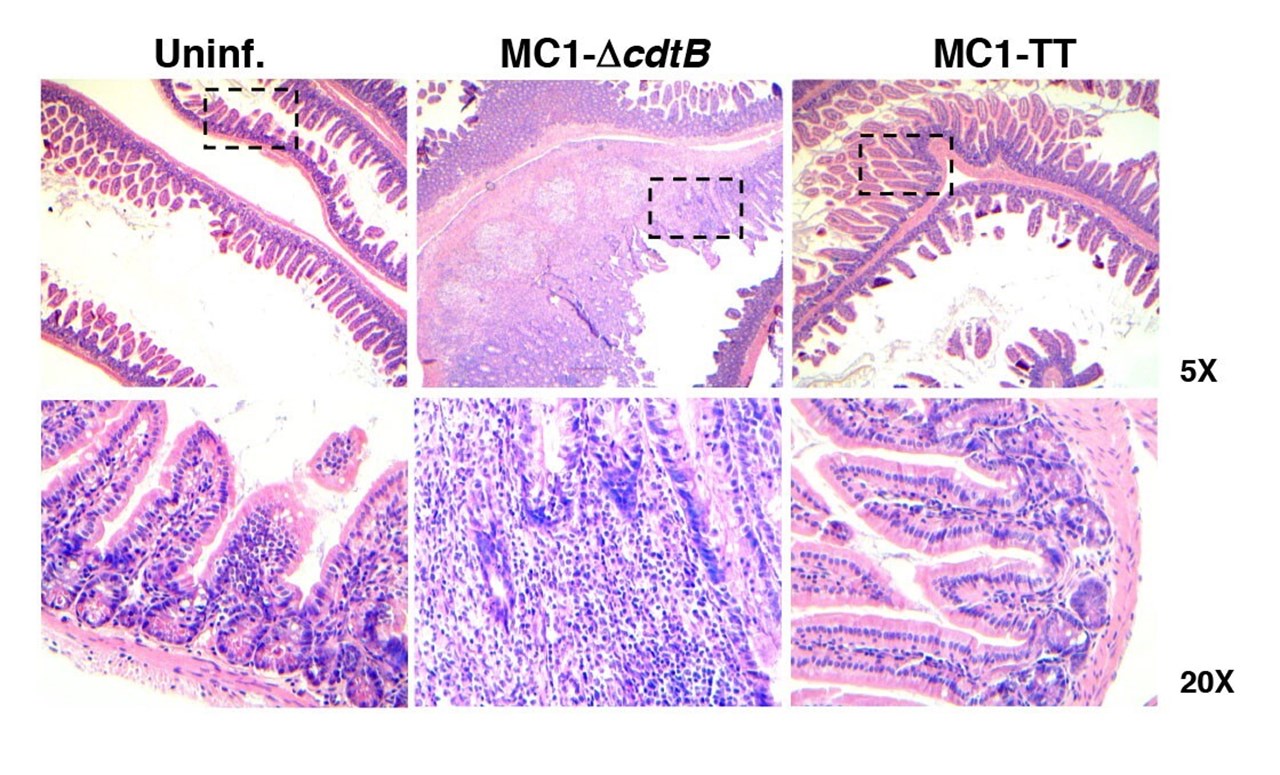
BildTeresa Frisan
Figur 2. Haematoxylin och eosinfärgning av tarmarna hos icke-infekterade möss eller möss som infekterats i 10 dagar med kontrollstammar (MC1-ΔcdtB) eller genotoxigena MC1-stammar (MC1-TT). De streckade rutorna anger det område som förstoras på den nedre panelen. Observera den framträdande inflammatoriska reaktionen som induceras av kontrollstammen, som saknas hos möss infekterade med bakterien som uttrycker tyfoidtoxinet.
Nästa steg är att förstå hur aktivering av DDR modulerar värdens immunsvar, och om slutresultatet är annorlunda hos friska försökspersoner och hos individer som är mottagliga för kronisk inflammation eller cancer. För att behandla denna fråga använder vi en kombination av in vivo- och 3D-mänskliga organotypiska modeller (figur 3).
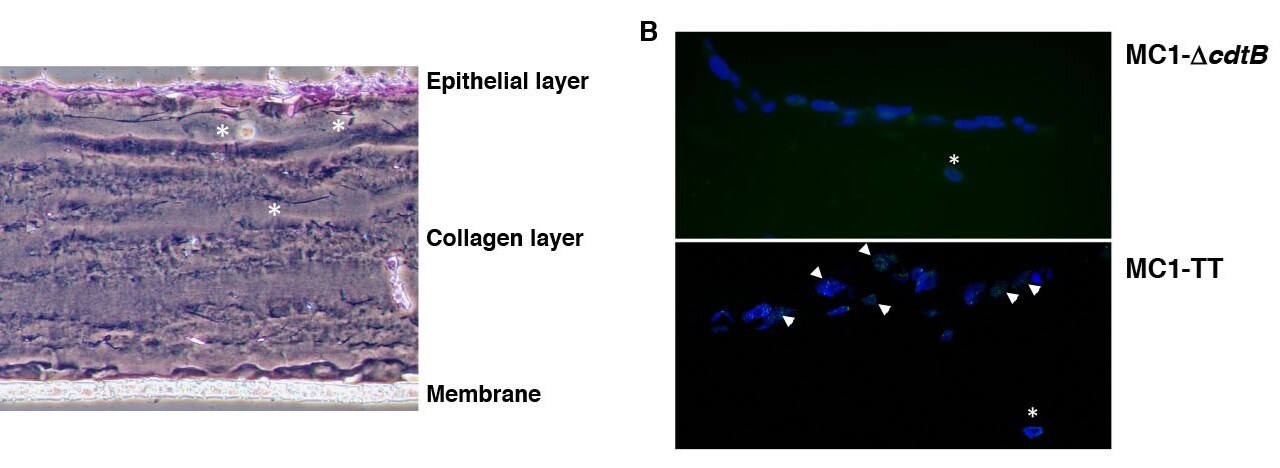
BildTeresa Frisan
Figur 3. Organotypiska 3D-modeller. A. Faskontrastmikrografi av kolonepitelceller, odlade i 3D-kultur och färgade med hematoxylin och eosin. B. Kolonepitelceller infekterade med kontroll (MC1-ΔcdtB) eller genotoxigenisk MC1 (MC1-TT)-stammar i 24 timmar. Aktivering av DDR bedömdes genom immunofluorescensanalys, genom att använda antikroppar som är specifika för 53BP1 (grön). Cellkärnor motfärgades med DAPI (blå). Pilarna indikerar cellpositiv för bildandet av 53BP1-härdar på platsen för det skadade DNA:t. De vita asteriskerna indikerar närvaron av fibroblaster i tjocktarmen inbäddade i kollagenmatrisen.
Vår cancerforskning fokuserar på salmonellabakteriella genotoxiner som skadar celler och i nästa steg vållar infektion, inflammation och cancer.
Epidemiologisk evidens har kunnat koppla kroniska bakterieinfektioner eller förändrade tarmmikrobiota (dysbios) till kronisk inflammation och cancer. Vilka molekylära mekanismer som främjar tumörbildning och tumörtillväxt och bestämmer dysbios, liksom huruvida detta är orsaken till eller en konsekvens av inflammatoriska/cancerösa lesioner, är dock okänt.
I denna komplexa kontext studerar vi bakteriella genotoxiner, som skadar DNA och orsakar cellulärt åldrande i värdcellerna, och vilken roll de spelar i att orsaka kroniska infektioner och förändra homeostasen i tarm-lever och gallvägar. Kolonisering med genotoxinproducerande bakterier bidrar under vissa omständigheter till att tumörer utvecklas. Den biologiska relevansen för dessa toxiner har dock inte fastställts, eftersom deras primära funktion sannolikt inte är att orsaka cancer hos värden. För att reda ut den frågan har vi konstruerat en modell som bygger på Salmonella typhimurium, som uttrycker det genotoxin som kallas för tyfustoxin. Det bör noteras att salmonella är den enda genotoxinproducerande bakterie som kan förknippas med cancer hos människan.
Mer specifikt vill vi förstå rollen som mikromiljön i vävnaden, toxininducerat cellulärt åldrande och immunologiska landskap hos friska försökspersoner eller vid tillstånd med benägenhet till inflammationssjukdom eller cancer spelar för att bestämma bakterieinfektionens pro-tumörogena utfall. Framsteg på området har hindrats av systemens komplexitet, med en mängd variabler såsom den vävnadsspecifika mikrobiella ekologin och värdens immunrespons. För att reda ut detta komplexa samspel har vi konstruerat en in vivo-modell och håller nu på att bygga ett immunkompetent organotypiskt vävnadsodlingssystem i 3D, med hjälp av vilket vi kommer att kunna fastställa de molekylära mekanismerna för bakterierelaterad karcinogenes. Forskningen kan resultera i specifika behandlingsprotokoll som riktar in sig på tidig, snabb och selektiv utrotning av bakteriepopulationer hos patienterna, vilket därmed skulle förhindra de första stegen av tumörutvecklingen, främja en bättre hälsa och minska kostnaderna för cancerbehandlingar.

Fem forskare inom UCMR får anslag från Cancerfonden.

Umeå universitet får totalt 48 300 000 kronor av Vetenskapsrådet 2021 till projekt inom medicin och hälsa.
Umeåforskare visar att bakterietoxiner är komplexa och kan fungera som modulatorer för värdens immunsvar.